Wissenschaftliches Board
Wissenschaftliche Leitung
Prof. Dr. med. Alexandra Bielfeld, Düsseldorf

Prof. Dr. med.
Alexandra Bielfeld, Düsseldorf

Prof. Dr. med.
Georg Griesinger, Lübeck

Prof. Dr. med.
Nicole Sänger, Bonn

Prof. Dr. med.
Volker Ziller, Marburg
Liebe Interessent:innen des FERRING Forums 2024,
Am 01. und 02. März 2024 fand in der Handelskammer Hamburg erneut das FERRING Forum Fertilität statt –mit wissenschaftlich hoch aktuellen Themen von der Grundlagenforschung bis in die Praxis. Neben den Vorträgen von nationalen sowie internationalen renommierten Referent*innen wurde auch wieder eine Vielzahl spannender Workshops angeboten, darunter solche zu Themen wie Social Media oder Transgendermedizin.
Auf dieser Seite finden Sie eine Übersicht vieler Inhalte wie eine Galerie mit einer Vielzahl von Bildern zur Ansicht.
Wir wünschen Ihnen nun viel Freude mit den Inhalten auf dieser Seite und danke für Ihr Interesse!
Beste Grüße

Stéphanie Caron
Geschäftsführerin | FERRING Arzneimittel GmbH

Dr. Christoph Goemann
Business Unit Director | RMMH
Bianca Koens
Business Unit Director | RMMH

Interview
mit Prof. Alexandra Bielfeld
Wissenschaftliche Leitung FERRING Forum 2024
Frage: Welche Rolle spielt das Ferring Forum für die Reproduktionsmedizin in Deutschland?
Bielfeld: Für mich ist das Ferring Forum das Jahresauftakts-Forum, bei dem bundesweit Reproduktionsmediziner zusammenkommen und die aktuellen State-of-the-Art-Themen diskutiert werden.
Frage: Welche Entwicklungen erwarten Sie für die Reproduktionsmedizin?
Bielfeld: In den letzten Jahren hat sich der Arztberuf bzw. die Sicht auf Ärzte sehr verändert. Heutzutage sind wir nicht nur Menschen im Gesundheitswesen, die das Beste für ihre Patienten im Auge haben, sondern wir sind auch Dienstleister geworden. Patienten erwarten dementsprechend auch Dienstleistungen wie in anderen Betrieben. Dazu gehört z. B., dass viele Informationen schon vor dem eigentlichen Praxisbesuch vorliegen sollen. Deswegen gewinnen auch Social Media und Webseiten immer mehr an Bedeutung. Das ist eine Aufgabe, der wir uns stellen müssen.
Eine weitere Herausforderung für die nächsten Jahre ist, dass unsere Labore immer technisierter werden und ggf. künstliche Intelligenz dort eine Rolle spielen wird. Ärzte werden dann als Hüter und Richtungsgeber fungieren.
Frederik Paulsen Preis 2024
Der zweijährlich verliehene und mit 20.000 € dotierte Frederik-Paulsen-Preis wird zur Unterstützung von hochqualitativen wissenschaftlichen Projekten und Forschungsvorhaben in der Reproduktionsmedizin verliehen. Beim diesjährigen Frederik-Paulsen-Preises setzte sich Dr. Bloeme van der Knoop aus den Niederlanden mit ihrem Projekt zur Endometriose gegen fünf Mitbewerberprojekte durch.
Damit wurde zum ersten Mal ein niederländisches Projekt mit dem begehrten Preis ausgezeichnet. Dr. van der Knoop wird sich in ihrer Studie sowohl mit der Diagnostik als auch der Therapie der tief infiltrierenden Endometriose (TIE) befassen.

Der von Ferring mit 20.000 € dotierte Frederik-Paulsen-Preis wird zur Unterstützung von hochqualitativen wissenschaftlichen Projekten und Forschungsvorhaben in der Reproduktionsmedizin verliehen.
Das Themenfeld umfasst neben der klassischen klinischen Forschung in der Reproduktionsmedizin auch die innovativen und zukunftsträchtigen Bereiche patientenzentrierte und individualisierte Medizin, wertbasierte Gesundheitsversorgung und digitale Trends in der Reproduktionsmedizin.

Übergabe des Frederik-Paulsen-Preises an Dr. Bloeme van der Knoop durch Prof. Georg Griesinger (links) und Prof. Joop Laven (rechts).
Das FERRING
Commitment:
Reduktion/Verzicht auf Tierversuche (3R-Prinzip)
FERRING hat sich dem 3R-Prinzip verschrieben, das darauf abzielt, Tierversuche vollständig zu vermeiden (Replacement) bzw. die Anzahl der Tiere (Reduction) sowie ihr Leiden (Refinement) in Versuchen auf das unerlässliche Maß zu beschränken. Follitropin delta ist das erste rekombinante Follikelstimulierende Hormon (rFSH), das unter Verwendung von In-vitro-Assays anstelle von Tierversuchen zugelassen wurde.
Insgesamt unterstreicht FERRING mit innovativen Ansätzen und Engagement seine führende Rolle in der Entwicklung fortschrittlicher Therapien auf dem Gebiet der assistierten Reproduktionstechnik (ART).
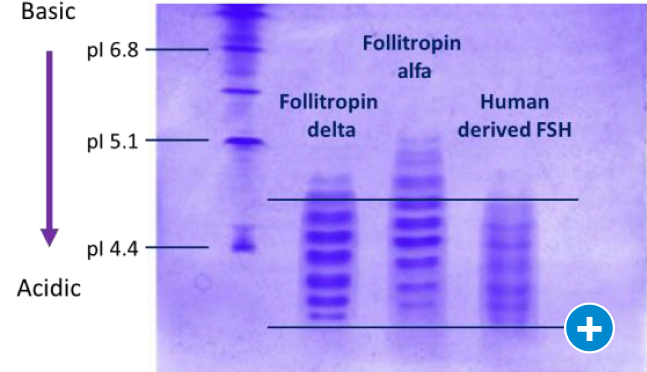
Eine bedeutende Innovation stellt Rekovelle® (Follitropin delta) dar. Follitropin delta ist das erste FSH, das aus einer menschlichen Zelllinie (PER.C6®) gewonnen wird und ähnliche Glykosylierungsmuster wie natürliches, physiologisches FSH aufweist (Abbildung 1) [Plaksin et al. 2021].
Session I:
Updates ESHRE-Leitlinien und WHO-Manual
Vorsitz:
Prof. Dr. med. Alexandra Bielfeld, Prof. (apl.) Dr. med. Volker Ziller
ESHRE-Empfehlungen zum wiederholten
Implantationsversagen
Abbildung 2: Empfehlungen der ESHRE zu RIF-spezifischen Untersuchungen und Interventionen für RIF; modifiziert nach [Cimadomo et al. 2023]. BMI: Body-Mass-Index, ESHRE: European Society of Human Reproduction and Embryology, FISH: Fluoreszenz-in-situ-Hybridisierung, G-CSF: Granulozyten-Kolonie-stimulierender Faktor, GnRHa: Gonadotropin-Releasing-Hormone-Agonisten, hCG: humanes Choriongonadotropin, HLA: humane Leukozytenantigene, NK-Zellen: natürliche Killerzellen, PBMC: periphere mononukleäre Blutzellen, PID: Präimplantationsdiagnostik, PRP: plättchenreiches Plasma, RIF: wiederholtes Implantationsversagen.

Prof. Dr. med. Georg Griesinger, Lübeck
Prof. Georg Griesinger, Lübeck, stellte in seinem Vortrag die aktuellen ESHRE-Empfehlungen bei wiederholtem Implantationsversagen (Recurrent Implantation Failure; RIF) vor, die 2023 erschienen sind.
Grundsätzlich handelt es sich bei Implantationsversagen um das Versagen der Einnistung eines in vitro gezeugten Embryos.
Ab wann wird jedoch von RIF gesprochen?
Es wurde der Konsens getroffen, dass die empfohlene Schwelle für RIF bei einer Schwangerschaftswahrscheinlichkeit von > 60 % liegt.
Für die Praxis bedeutet dies, die individuellen Chancen einer Lebendgeburt mithilfe von www.ivfpredict.com zu berechnen und anschließend zu ermitteln, ab dem wievielten Embryotransfer (ET) der RIF-Schwellenwert von 60 % erreicht wird.
Überschreitet die zu erwartende individuelle kumulative Chance nach der errechneten Anzahl von ET die 60 %, ohne dass eine Implantation eintritt, so sollte über weitere Untersuchungen und/oder Behandlungsoptionen beraten werden [Cimadomo et al. 2023]. Die dazugehörigen Empfehlungen der ESHRE sind in Abbildung 2 dargestellt.
Session II:
PCOS und Adipositas
Vorsitz:
Prof. Dr. med. Nicole Sänger, Prof. Dr. med. Alexandra Bielfeld
Das polyzystische Ovarialsyndrom (PCOS)
Prof. Dr. med. Katharina Hancke, Ulm

Prof. Dr. Joop Laven, Rotterdam, NL

Im Jahr 2023 ist das aktuelle Update der internationalen Leitlinie zum PCOS erschienen. In Deutschland wird erstmalig an einer nationalen Leitlinie gearbeitet, deren Fertigstellung für 2024 geplant ist, berichtete Prof. Katharina Hancke, Ulm. Neu ist in den internationalen Leitlinien z. B., dass der Anti-Müller-Hormon-(AMH-)Wert als alternatives Diagnostikkriterium aufgenommen wurde und somit die Sonographie ersetzen kann.
Zu beachten ist jedoch, dass bei Jugendlichen weder die vaginale Sonographie noch die AMH-Messung zur Diagnose eines PCOS verwendet werden soll [Teede et al. 2023]. Diese beiden Aspekte werden auch in den deutschen Leitlinien Beachtung finden.
Der Vortrag von Prof. Joop Laven, Rotterdam, widmete sich der optimalen ovariellen Stimulation bei Frauen mit PCOS. Unverändert gilt die Off-Label-Behandlung mit Letrozol als Erstlinientherapie bei der Ovulationsinduktion.
Als Alternative zu der Gabe von Gonadotropinen steht für Frauen mit PCOS und Clomifenresistenz eine laparoskopische Operation, das sogenannte ovarielle Drilling, als Zweitlinienoption zur Verfügung [Teede et al. 2023].
In der Drittlinie ist die In-vitro-Fertilisation (IVF) eine Option, die bei Frauen mit anovulatorischem PCOS wirksam ist. Für die ovarielle Stimulation im IVF-Protokoll wird keine Empfehlung für spezifische Gonadotropine gegeben [Teede et al. 2023].
Prof. Laven hob hierbei jedoch Follitropin delta hervor, welches als erstes rFSH-Präparat einen individuellen Dosierungsalgorithmus basierend auf BMI und AMH-Wert besitzt.
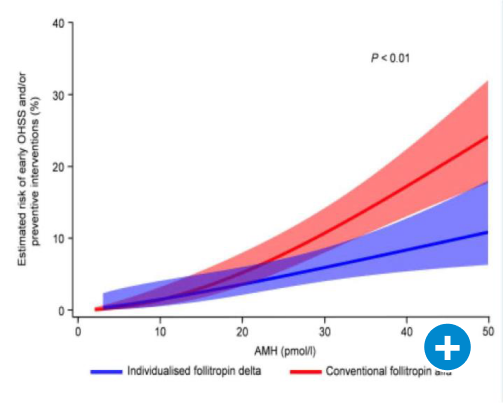
Studiendaten zeigen, dass Follitropin delta im Vergleich zu Follitropin alfa mit einem geringeren Risiko für ein ovarielles Überstimulationssyndrom (OHSS; Abbildung 3) und einer besseren Lebendgeburtenrate einhergeht [Qiao et al. 2021].
Prof. Laven konnte die OHSS-Risikoreduzierung für sein eignes Institut bestätigen: Hier hat sich seit der Anwendung von Follitropin delta die OHSS-Rate von ein bis zwei Fällen pro Monat auf vier pro Jahr reduziert.
Abbildung 3: OHSS-Risiko unter Follitropin delta oder Follitropin alfa; modifiziert nach [Qiao et al. 2021]. AMH: Anti-Müller-Hormon, OHSS: ovarielles Überstimulationssyndrom.
Adipositas
Dr. med. Karsten Behle, Köln

Adipositas ist eine chronische Krankheit, die in entwickelten Ländern und Entwicklungsländern verbreitet ist und Kinder wie Erwachsene betrifft [WHO 2024]. Dr. Karsten Behle, Köln, sprach diesbezüglich von einem pandemischen Ausmaß.
Auch bei Kinderwunsch spielt Adipositas eine wesentliche Rolle. Frauen, die übergewichtig oder adipös sind, weisen eine erhöhte Rate an Fertilitätsstörungen und Infertilität auf und haben ein erhöhtes Risko für Fehlgeburten sowie Schwangerschaftskomplikationen [Silvestris et al. 2018]. Laut Dr. Behle kann davon ausgegangen werden, dass in Deutschland etwa eine Million adipöse Frauen ungewollt kinderlos sind. Diese Patientinnen benötigen eine spezifische Therapie, um ihre Adipositas zu bekämpfen.
Je nach Ausprägung der Adipositas stehen verschiedene Optionen zur Verfügung. Basis jeder Adipositastherapie ist eine Kombination aus Ernährungs-, Bewegungs- und Verhaltenstherapie (z. B. mittels psychologischer Betreuung).
Damit sich ein dauerhafter Erfolg einstellt, muss eine langfristige Lebensstiländerung stattfinden; eine zeitlich begrenzte Diät ist nicht förderlich.
Besonders im Kontext der Kinderwunschtherapie ist die Behandlung von Adipositas ein vielversprechender Ansatz, da Personen in diesem Bereich motiviert sind, Lebensstiländerungen vorzunehmen, um ihre Chancen auf eine Schwangerschaft zu erhöhen.
Die Adipositastherapie wird zunehmend auch medikamentös stattfinden (zusätzlich zu den Basismaßnahmen). Hier sind z. B. die GLP-1-Analoga zu nennen, die aktuell als „Abnehmspritzen“ in der Öffentlichkeit stehen. Derzeit werden diese Medikamente jedoch noch nicht erstattet, wenn sie zur Adipositastherapie eingesetzt werden, da es sich laut Sozialgesetzbuch V um „Lifestyle“-Arzneimittel handelt. Besteht jedoch aufgrund eines Diabetes eine medizinische Indikation, so ist das Medikament erstattungsfähig.
Session III:
International Highlights
Vorsitz:
Prof. Dr. Joop Laven, Prof. Dr. med. Georg Griesinger
p63 – Schlüsselrolle bei der genetischen Kontrolle von Oozyten und Auswirkungen auf die Fertilität
Prof. Dr. Volker Dötsch, Frankfurt

Im Unterschied zu Männern, die ihr Leben lang neue Spermien produzieren können, werden Frauen mit einer endlichen Anzahl an primären Oozyten geboren.
Um das Risiko von genetischen Defekten beim Nachwuchs zu minimieren, initiieren Oozyten bei DNA-Schäden die Apoptose. Dieser Prozess wird durch das Protein p63 gesteuert. Prof. Volker Dötsch, Frankfurt am Main, erläuterte in seinem Vortrag, welche Mechanismen hinter diesem Vorgang stecken.
In gesunden Oozyten liegt die oozytenspezifische Isoform von p63 (TAp63α) in einer geschlossenen, inaktiven, dimerischen Konformation vor.
DNA-Schäden, vor allem Doppelstrangbrüche, führen zur Aktivierung einer Kinasekaskade und so zu einer Phosphorylierung von TAp63α, woraus eine Konformationsänderung und die Bildung einer offenen, aktiven sowie tetrameren Konformation resultieren. In dieser Form kann das Protein an DNA binden und die Expression proapoptotischer Faktoren steuern.
Da Bestrahlung und viele chemotherapeutische Wirkstoffe DNA-Schäden verursachen, können Krebstherapien bei Frauen durch Aktivierung von TAp63α zur Eliminierung von Oozyten und damit zur frühzeitigen Menopause und Unfruchtbarkeit führen.
Eine Option, die die volle Funktion der Ovarien erhält, aber den Beginn der onkologischen Therapie nicht verzögert und keine Operation erfordert, wäre, primäre Oozyten während der Behandlung pharmakologisch, z. B. durch Kinaseinhibitoren, zu schützen. Im Mausmodell wurde bereits gezeigt, dass die durch Cisplatin oder Doxorubicin ausgelöste, apoptosebedingte Reduktion der Oozyten durch die Zugabe von Kinaseinhibitoren verhindert und somit die Oozyten geschützt werden konnten.
Jetzt müssen diese Ergebnisse auf menschliches Ovargewebe übertragen werden, um die Wirksamkeit von Kinaseinhibitoren auch hier zu prüfen [Tuppi et al. 2018].
Präimplantations-Gentests für Embryo-Aneuploidie
Prof.ssa Laura Rienzi, Rome, IT

Die menschliche Fertilität wird von Oozytenaneuploidien geprägt und es ist verbreitet, dass menschliche Embryonen Aneuploidie aufweisen. Dies kann zu Komplikationen wie Implantationsversagen, Fehlgeburten oder Fehlbildungen führen [Gruhn et al. 2019].
Der Präimplantationstest zur genetischen Aneuploidiedetektion (PGT-A) ist eine Technik, mit der Embryonen vor der Implantation im Labor genetisch analysiert werden können.
Heutzutage stellt die Trophektodermbiopsie mit Next Generation Sequencing (NGS) den Goldstandard dar, um auf Euploidie/ Aneuploidie zu testen, erläuterte Associate Prof. Laura Rienzi, Urbino. Studiendaten zeigen, dass dieses Verfahren hochprognostisch für das Ausbleiben einer erfolgreichen Geburt ist, wenn ein aneuploides Ergebnis vorliegt. Darüber hinaus hat die Trophektodermbiopsie keinen nachweisbaren nachteiligen Einfluss auf die Implantation [Tiegs et al. 2021]. Allerdings erfordert das Verfahren geschultes Personal mit hohen technischen Fähigkeiten sowie spezielles Equipment, woraus hohe Kosten und potenzielle Risiken, wie die mögliche Beeinträchtigung oder Entsorgung lebensfähiger Embryonen, resultieren.
Eine Alternative könnte die Untersuchung der embryonalen zellfreien DNA (cfDNA) bieten, die im verbrauchten Kulturmedium vorhanden ist.
Aktuell besteht jedoch eine erhebliche Varianz in den Ergebnissen zwischen den Studien, wobei die Konkordanzrate zwischen den Ergebnissen aus den Kulturmedien und der Trophektodermbiopsie zwischen 3,5 und 90 % liegt [Jiao et al. 2019, Rubio et al. 2020, Shamonki et al. 2016].
Ein bedeutendes Problem besteht in der Kontamination mit maternaler DNA [Chen et al. 2015]. Daher sind die Erhöhung der embryonalen cfDNA und die Minimierung maternaler Kontamination wichtige Faktoren für einen zukünftigen Einsatz der Technik in der klinischen Praxis. Aktuell ist die Methode jedoch noch zu fehleranfällig, um in der Klinik Anwendung zu finden [Hanson et al. 2021].
Bioaktivität von LH und hCG
Im Verlauf des Zyklus ist LH (luteinisierendes Hormon) entscheidend daran beteiligt, einen Follikel für die Reifung zu selektieren [Filicori et al. 2002].
Der LH-Rezeptor ist jedoch nicht ausschließlich durch LH aktivierbar: Auch humanes Choriongonadotropin (hCG) aktiviert diesen Rezeptor. In einem natürlichen Zyklus kann bis zu ein Drittel der LH-Bioaktivität in der follikulären Phase auf hCG zurückzuführen sein [Choi und Smitz 2014]. hCG weist dabei eine deutlich längere Halbwertszeit im menschlichen Blutkreislauf auf als LH [le Cotonnec et al. 1998, Trinchard-Lugan et al. 2002]. Dies kann zu unterschiedlichen biologischen Effekten führen [Casarini et al. 2016].
Prof. Scott Nelsen, Glasgow, führte in seinem Vortrag aus, welche Auswirkungen diese Unterschiede auf die Auswahl des Stimulationsprotokolls haben.
So scheint eine Supplementierung mit rekombinantem LH (zusätzlich zu Follitropin alfa) nicht zu einem verbesserten klinischen Outcome zu führen [Behre et al. 2015, Hua und Wang 2023, Humaidan et al. 2017, Vuong et al. 2015].
Wie sieht die Evidenz jedoch für HP-hMG aus? HP-hMG zeichnet sich durch eine hohe hCG-Konzentration und eine niedrige LH-Konzentration aus, sodass praktisch die gesamte Bioaktivität am LH-Rezeptor von hCG erzeugt wird.
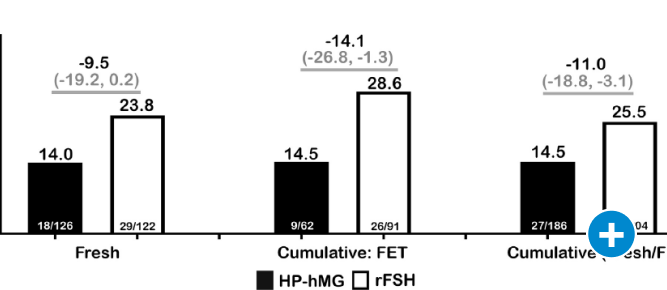
Abbildung 4: Früher Schwangerschaftsverlust unter HP-hMG vs. rFSH alfa bei High Respondern; modifiziert nach [Witz et al. 2020]. FET: Frozen Embryo Transfer, HP-hMG: hochgereinigtes humanes Menopausengonadotropin, rFSH: rekombinantes Follikel-stimulierendes Hormon.
Daten der MEGASET-HR-Studie zeigen, dass HP-hMG und rFSH alfa mit einer vergleichbaren Schwangerschaftsrate bei High Respondern (Serum-AMH ≥ 5 ng/ml) einhergehen, HP-hMG jedoch mit einer geringeren Anzahl an unerwünschten Ereignissen, einschließlich frühem Schwangerschaftsverlust (Abbildung 4), assoziiert ist.
Die Ergebnisse legen nahe, dass HP-hMG in dieser Population ein optimiertes Nutzen-Risiko-Profil aufweist [Witz et al. 2020]. Auch im direkten Vergleich zwischen HP-hMG und rFSH alfa + rLH (2:1) konnte eine geringere Anzahl von Oozyten mit vergleichbaren Schwangerschaftsraten verbunden werden [Kirshenbaum et al. 2021, Pacchiarotti et al. 2010].
Seit dem vergangenen Jahr ist HP-hMG im Fertigpen erhältlich. Besonders vor dem Hintergrund, dass Fertigpens bei Patientinnen und Fachpersonal gleichermaßen beliebt sind [De Mesmaeker et al. 2023], stellt der HPhMG-Fertigpen eine bedeutende Bereicherung auf dem Markt für die ovarielle Stimulation dar.
Bioaktivität von LH und hCG
Prof. Scott Nelson, Glasgow, UK

Im Verlauf des Zyklus ist LH (luteinisierendes Hormon) entscheidend daran beteiligt, einen Follikel für die Reifung zu selektieren [Filicori et al. 2002]. Der LH-Rezeptor ist jedoch nicht ausschließlich durch LH aktivierbar: Auch humanes Choriongonadotropin (hCG) aktiviert diesen Rezeptor. In einem natürlichen Zyklus kann bis zu ein Drittel der LH-Bioaktivität in der follikulären Phase auf hCG zurückzuführen sein [Choi und Smitz 2014]. hCG weist dabei eine deutlich längere Halbwertszeit im menschlichen Blutkreislauf auf als LH [le Cotonnec et al. 1998, Trinchard-Lugan et al. 2002]. Dies kann zu unterschiedlichen biologischen Effekten führen [Casarini et al. 2016]. Prof. Scott Nelsen, Glasgow, führte in seinem Vortrag aus, welche Auswirkungen diese Unterschiede auf die Auswahl des Stimulationsprotokolls haben. So scheint eine Supplementierung mit rekombinantem LH (zusätzlich zu Follitropin alfa) nicht zu einem verbesserten klinischen Outcome zu führen [Behre et al. 2015, Hua und Wang 2023, Humaidan et al. 2017, Vuong et al. 2015]. Wie sieht die Evidenz jedoch für HP-hMG aus? HP-hMG zeichnet sich durch eine hohe hCG-Konzentration und eine niedrige LH-Konzentration aus, sodass praktisch die gesamte Bioaktivität am LH-Rezeptor von hCG erzeugt wird. Daten der MEGASET-HR-Studie zeigen, dass HP-hMG und rFSH alfa mit einer vergleichbaren Schwangerschaftsrate bei High Respondern (Serum-AMH ≥ 5 ng/ml) einhergehen, HP-hMG jedoch mit einer geringeren Anzahl an unerwünschten Ereignissen, einschließlich frühem Schwangerschaftsverlust (Abbildung 4), assoziiert ist.
Abbildung 4: Früher Schwangerschaftsverlust unter HP-hMG vs. rFSH alfa bei High Respondern; modifiziert nach [Witz et al. 2020]. FET: Frozen Embryo Transfer, HP-hMG: hochgereinigtes humanes Menopausengonadotropin, rFSH: rekombinantes Follikel-stimulierendes Hormon.
Die Ergebnisse legen nahe, dass HP-hMG in dieser Population ein optimiertes Nutzen-Risiko-Profil aufweist [Witz et al. 2020]. Auch im direkten Vergleich zwischen HP-hMG und rFSH alfa + rLH (2:1) konnte eine geringere Anzahl von Oozyten mit vergleichbaren Schwangerschaftsraten verbunden werden [Kirshenbaum et al. 2021, Pacchiarotti et al. 2010]. Seit dem vergangenen Jahr ist HP-hMG im Fertigpen erhältlich. Besonders vor dem Hintergrund, dass Fertigpens bei Patientinnen und Fachpersonal gleichermaßen beliebt sind [De Mesmaeker et al. 2023], stellt der HPhMG-Fertigpen eine bedeutende Bereicherung auf dem Markt für die ovarielle Stimulation dar.
Session IV:
Sicherheit im IVF-Labor
Vorsitz:
Prof. Dr. med. Nicole Sänger, Prof. (apl.) Dr. med. Volker Ziller
Ronny Janssens, BSc, Brussels, Belgien

Dr. Viktor Oubaid, Hamburg

Das fehlerfreie IVF-Labor ist eine schöne Vorstellung, entspricht jedoch einer Illusion, so Ronny Janssens, Brüssel. Dies verdeutlicht die Komplexität von Laborfehlern, die häufig auf eine Kombination aus menschlichen Fehlern (z. B. Ablenkung, Fatigue), technischen Herausforderungen (z. B. schlechter technischer Zustand von Geräten) und organisatorischen Schwächen (hohe Arbeitsbelastung, Personalmangel) zurückzuführen sind.
Ein gut durchgeführtes Risikomanagement gehört daher zu den Standardanforderungen an ein IVF-Labor und es stehen verschiedene Leitfäden zur Verfügung, die den Prozess unterstützen können, wie z. B. die Leitlinien der ESHRE [De los Santos et al. 2016] oder der Leitfaden des European Directorate for the Quality of Medicines & Health Care (EDMQ) [EDQM 2022].
Es ist anzumerken, dass medizinische bzw. laborbezogene Fehler nicht zwangsläufig unangemessenes, fahrlässiges oder unethisches Verhalten darstellen, aber das Versäumnis, sie offenzulegen, diesen drei Verfehlungen entspricht [Ritchie und Davies 1995].
Durch eine systematische Analyse von Fehlern können Muster erkannt, Ursachen identifiziert und geeignete Maßnahmen ergriffen werden, um ähnliche Fehler in der Zukunft zu vermeiden. Zur Minimierung von Fehlern im Labor sind eine angemessene Personalbesetzung und Schulung entscheidend. Die empfohlenen Personalbesetzungsstandards für ein IVF-Labor sehen pro 120 Stimulationszyklen/Jahr einen Vollzeit-Embryologen vor – eine Zahl, die in den meisten Laboren jedoch nicht erreicht wird.

Dr. Viktor Oubaid, Leiter der Abteilung Luft- und Raumfahrtpsychologie, Hamburg, knüpfte an den Vortrag seines Vorredners an und berichtete über Ursachen von Komplikationen und wie diese durch eine gute Personalauswahl minimiert werden können.
Häufig wird bei der Auswahl des Personals primär auf formale und fachliche Qualifikationen geachtet, entscheidend ist jedoch oftmals die Persönlichkeit.
Eine effektive Teamdynamik, in der verschiedene Persönlichkeiten aufeinander abgestimmt sind, kann den Lernfortschritt beschleunigen und somit dazu beitragen, eventuell am Anfang bestehende fachliche Defizite rascher auszugleichen.
Referenten
des FERRING Forum 2024













Galerie


Literatur
Behre HM, Howles CM und Longobardi S. Reprod Biomed Online 2015;31(3):339-46
Casarini L, Brigante G, Simoni M, et al. Prog Mol Biol Transl Sci 2016;143:85-1199 For Internal Use – Internal
Chen M, Wei S, Hu J, et al. PLoS One 2015;10(10):e0140779
Choi J und Smitz J. Mol Cell Endocrinol 2014;383(1-2):203-13
Cimadomo D, de Los Santos MJ, Griesinger G, et al. Hum Reprod Open 2023;2023(3):hoad023
De los Santos MJ, Apter S, Coticchio G, et al. Hum Reprod 2016;31(4):685-6
De Mesmaeker G, Calles B und Smith JA. Patient Prefer Adherence 2023;17:1281-92
EDQM. 2022. https://www.edqm.eu/en/guide-to-the-quality-and-safety-of-tissues-and-cells-for-human-application1. Abgerufen am 12.03.2024
Filicori M, Cognigni GE, Samara A, et al. Hum Reprod Update 2002;8(6):543-57
Gruhn JR, Zielinska AP, Shukla V, et al. Science 2019;365(6460):1466-9
Hanson BM, Tao X, Hong KH, et al. Fertil Steril 2021;115(6):1461-70
Hua L und Wang C. Eur J Obstet Gynecol Reprod Biol 2023;283:43-8
Humaidan P, Chin W, Rogoff D, et al. Hum Reprod 2017;32(3):544-55
Jiao J, Shi B, Sagnelli M, et al. Hum Reprod 2019;34(7):1369-79
Jonker DM, Koch M, Larsson P, et al. Int J Clin Pharmacol Ther 2021;59(12):794-803
Kirshenbaum M, Gil O, Haas J, et al. Reprod Biol Endocrinol 2021;19(1):182
le Cotonnec JY, Porchet HC, Beltrami V, et al. Fertil Steril 1998;69(2):189-94
Pacchiarotti A, Sbracia M, Frega A, et al. Fertil Steril 2010;94(6):2467-9
Plaksin D, Jespersen S, Keinan M, et al. ASRM Scientific Congress Baltimore, 2021.
Qiao J, Zhang Y, Liang X, et al. Hum Reprod 2021;36(9):2452-62
Ritchie JH und Davies SC. BMJ 1995;310(6984):888-9
Rubio C, Navarro-Sánchez L, García-Pascual CM, et al. Am J Obstet Gynecol 2020;223(5):751.e1-.e13
Shamonki MI, Jin H, Haimowitz Z, et al. Fertil Steril 2016;106(6):1312-8
Silvestris E, de Pergola G, Rosania R, et al. Reprod Biol Endocrinol 2018;16(1):22
Teede HJ, Tay CT, Laven JJE, et al. Eur J Endocrinol 2023;189(2):G43-g64
Tiegs AW, Tao X, Zhan Y, et al. Fertil Steril 2021;115(3):627-37
Trinchard-Lugan I, Khan A, Porchet HC, et al. Reprod Biomed Online 2002;4(2):106-15
Tuppi M, Kehrloesser S, Coutandin DW, et al. Nat Struct Mol Biol 2018;25(3):261-9
Vuong TN, Phung HT und Ho MT. Hum Reprod 2015;30(5):1188-9510 For Internal Use – Internal
WHO. 2024. https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight. Abgerufen am 13.03.2024
Witz CA, Daftary GS, Doody KJ, et al. Fertil Steril 2020;114(2):321-30
Veranstaltungsorganisation
SoftconsuLt
Anne Becker
Weißdornweg 17, 35041 Marburg
Tel.: 06420 934 44
E-Mail: softconsult@web.de
Veranstalter
FERRING Arzneimittel GmbH
Tanja Hildmann
Fabrikstr. 7, 24103 Kiel
Tel.: 0431 58 52 222
Mobil: 0173 6898 205
Fax: 0431 58 52 196
E-Mail: tanja.hildmann@ferring.com